|
|
7. Trichuriosis.
7.1. Síntomas.
7.2. Diagnóstico.
7.3. Tratamiento.
7.4. Profilaxis.
8. Enfermedades parasitarias ocasionadas por cestodos Monieziosis en rumiantes.
8.1. Ciclo biológico.
8.2. Diagnóstico.
8.3. Patogenia.
8.4. Tratamiento y control.
9. Coccidiosis.
9.1. Ciclo biológico.
9.2. Síntomas.
9.3. Diagnóstico.
9.4. Tratamiento.
9.5. Prevención.
10. Técnicas de diagnóstico ante mortem.
10.1. Técnica cuantitativa de Mc Master.
10.2. Técnica de Wisconsin.
10.3. Técnica de Wiscosin modificada.
10.3.1. Interpretación del recuento de huevos de estróngilos digestivos por grano de haces en rumiantes.
10.3.2. Utilidad de la coproscopía cuantitativa en helmintología de rumiantes.
10.3.3. Examen parasitológico del calostro o de la leche.
10.3.4. Procedimiento.
10.4. Técnica de Baerman.
10.4.1. Fundamento de esta técnica.
10.4.2. Material necesario.
10.4.3. Procedimiento.
11. Bibliografía.
7. TRICHURIOSIS.
Enfermedad parasitaria debida a la presencia de nematodos de la familia Trichuridae y al genero Trichuris, localizados a nivel del ciego y del colon de sus hospedadores, es una afección cosmopolita cuya infestación es debida a la ingestión de huevos embrionados (L1), se trata de un ciclo monoxeno directo, de ahí su amplia distribución a nivel mundial. En los bovinos y los ovinos las especies de mayor importancia son: T. globulosa (bovinos) y Trichuris ovis (ovinos y caprinos).
7.1. Síntomas.
La sintomatología de la trichuriosis se observa básicamente en los animales jóvenes y solo en casos de infestaciones masivas debido a su acción traumática. Los síntomas comunes son diarrea, algunas veces hemorrágica, enflaquecimiento, mal estado general y anemia, debido a que los trichuris son hematófagos, aunque su acción expoliatriz es de poca importancia.
7.2. Diagnóstico.
En vista de que la mayoría de las infestaciones son ligeras y asintomáticas, el diagnóstico clínico es casi imposible. El diagnóstico de certeza es aportado por la coproscopía ya que los huevos de los parásitos de este género son de morfología inconfundible.
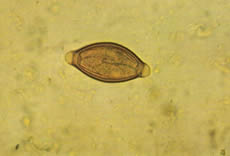
7.3. Tratamiento.
Los probenzomidazoles, benzimidazoles, las avermectinas / milbemicinas y el levamisol inyectables, son muy eficaces contra los Trichuris adultos, pero poco efectivos contra las formas larvarias.
7.4. Profilaxis.
Es rara vez necesaria en el caso de los rumiantes.
8. ENFERMEDADES PARASITARIAS OCASIONADAS POR CESTODOS.
La monieziosis es una cestodiosis ocasionada por cestodos del género Moniezia: M. expansa en ovinos y caprinos y M. benedeni principalmente en bovinos. En nuestro país esta parasitosis está principalmente afectada por la precipitación y su incidencia y prevalencia son mayores en animales jóvenes. En adultos, esta parasitosis esta influenciada por factores nutricionales, por el estrés (fisiológico o de manejo) y por enfermedades intercurrentes, factores todos ellos que pueden afectar negativamente los mecanismos inmunológicos, impactando negativamente sobre la relación hospedador-parásito.
El género Moniezia se caracteriza por tener un escolex inerme, sin ganchos ni rostellum, con cuatro ventosas (ver Fig. 1) y proglótides mas anchos que largos.
8.1. Ciclo biológico.
El ciclo biológico de Moniezia spp es indirecto con la participación de un hospedador intermediario, un ácaro microscópico de la familia Oribatidae, (ver Fig.2) que tiene hábitos coprófagos y que vive en el pasto. Dicho ácaro se infecta al ingerir los huevos del cestodo presentes en las heces y en su interior se va a formar una larva cisticercoide, al cabo de aproximadamente cuatro meses, esta será la forma infectante para los rumiantes cuando al alimentarse de pasto consuman las larvas cisticercoides. En el intestino delgado de los rumiantes, dichas larvas se liberarán del ácaro y se van a transformar en adultos en aproximadamente seis semanas, estos parásitos pueden llegar a medir hasta 5 metros. Los últimos segmentos que son los ovígeros o grávidos se desprenderán y saldrán al medio exterior en donde se desintegrarán y al ser consumidos por los ácaros oribátidos los infestarán garantizándose de esta manera la permanencia de la infestación por este parásito en la explotación. La infestación parasitaria de los oribátidos dura tanto como su vida (15 a 18 meses), lo cual garantiza la perennidad de la infección de la pradera. La proliferación de los oribátidos se ve incrementada por la pluviometría, pero cuando esta es excesiva o en sistemas de irrigación artificial, se ve perjudicada.
8.2. Diagnóstico.
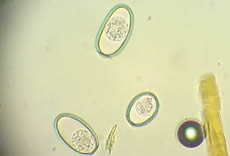
La visualización de los proglótides grávidos, de color blanco opaco sobre las heces (ver Fig. 3) o en las márgenes del año, permiten un diagnóstico exacto de la monieziosis. La coproscopía es de utilidad reducida y no interesa el diagnóstico cuantitativo, sólo interesa saber si el animal está o no parasitado. Sin embargo, los huevos (ver Fig. 4) estarán presentes en las heces pues los segmentos ovígeros al romperse permiten su mezcla con la materia fecal y pueden por ende, ser vistos mediante la coproscopía de concentración por flotación.

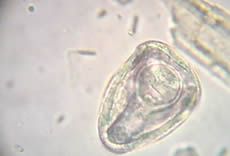
8.3. Patogenia.
Frecuentemente la monieziosis se presenta de manera subclínica y no se manifiesta sino por la presencia de los segmentos ovígeros en las heces o en las márgenes del ano. Sin embargo, esta parasitosis no debe subestimarse, pues va a producir una disminución de la productividad del ganado y de la rentabilidad en la explotación. Dado que los parásitos, sobre todo si se trata de una infección importante, pues rara vez están solos, ejercen una acción expoliatríz sobre ciertos nutrientes importantes como la metionina, vitamina B y calcio. Ejercen además una acción irritante sobre la mucosa intestinal, lo cual le ocasiona al animal alteraciones en el proceso de absorción de los nutrientes.
8.4. Tratamiento y control.
Se pueden utilizar las siguientes drogas:
Una recomendación importante es la de tratar a los animales en un corral de descarga, antes de soltarlos a potrero, pues en vista de que estos productos no tienen acción sobre los embrióforos de las moniezias, se sembraría el potrero con huevos del parásito y se agravaría aún más el problema, ya que la presencia de los ácaros oribátidos en los potreros es un hecho común y el no tomar esta previsión en vez de ayudar al control de esta parasitosis, más bien incrementaría el riesgo de infestación tanto para los hospedadores intermediarios como para los definitivos.
9. COCCIDIOSIS.
La coccidiosis de los rumiantes es una afección intestinal ocasionada por protozoarios del género Eimeria: coccidias. Aunque no se trata de una helmintosis, su localización intestinal, su epidemiología y por estar frecuentemente asociada con los estróngilos digestivos y ser diagnosticada por las mismas técnicas coproparasitológicas, consideramos de interés incluirlas en el presente articulo. La coccidiosis de los rumiantes es cosmopolita y las especies son numerosas, aunque afortunadamente no todas revisten importancia patógena, por ejemplo en bovinos se señalan básicamente a las especies E. bovis, E. zuerni y E.auburnensis, como las especies con un rol patógeno definido y constante, mientras que en los pequeños rumiantes se implican fundamentalmente como las mas patógenas a las siguientes especies: E. Ninaklholyakimovae y E. arloingi en las cabras y a E. Ovina E. ovnoidalis en los ovinos y a E. parva en ambos hospedadores.
9.1. Ciclo biológico.
El ciclo se divide en tres fases: esporulación, infección y schizogonya y finalmente gametogonia y formación de ooquistes, siendo la contaminación del hospedador debida a la ingestión de ooquistos esporulados.
9.2. Síntomas.
La presencia de coccidias no significa coccidiosis y cuando la coccidiosis clínica se hace presente, el numero de ooquistes por gramo de heces puede ser muy variable, llegando incluso a ser muy bajo sobre todo en casos de diarrea hemorrágica profusa, de la misma manera que un animal en buenas condiciones de salud puede arrojar cantidades elevadas de ooquistos por gramo de heces.
Las coccidias provocan una enteritis catarral, el contenido del intestino es rojizo, liquido y de olor fétido, hay destrucción de las glándulas intestinales con descamación del epitelio.
9.3. Diagnóstico.
Para un adecuado diagnostico se deben considerar los signos clínicos y en infecciones patentes la presencia de ooquistos de especies patógenas en las heces. El diagnostico se realiza mediante exámenes coproscópicos clásicos como los métodos de Willis, McMaster o Wisconsin. Para un correcto diagnóstico es de interés realizar coprocultivos para garantizar la esporulación de los ooquistes, ya que estos presentan características morfológicas que permiten la identificación especifica.
9.4. Tratamiento.
El tratamiento con sulfamidina, administrado oral o parenteralmente y repetido con la mitad de la dosis suministrada inicialmente por dos días consecutivos es recomendable, alternativamente puede usarse el amprolium o el decoquinato. En explotaciones intensivas en las cuales se presentan frecuentes brotes de coccidiosis, es recomendable administrar con el alimento concentrado bajos niveles de amprolium o decoquinato.
9.5. Prevención.
La prevención se basa en un adecuado manejo y prácticas de higiene básicas, prestando particular atención a la limpieza de comederos y bebederos los cuales no deben permitir que los animales defequen en el alimento, así como la limpieza periódica del piso de los establos, cambio periódico de la cama y en general mantener los pisos lo mas secos posible.
Nombre genérico |
Vía de Administración |
Dosis (mg/Kg.) |
Espectro de actividad |
Benzimidazoles |
|||
| Sulfoxido de Albendazol ** | Sub – cutánea, Oral |
3.75 – 4 7 - 10 |
Nematodos gastroentéricos y cestodos |
| Albendazole | Oral |
5 – 7.5 |
Nematodos gastroentéricos, pulmonares y céstodos |
| Cambendazole | Oral |
20- 25 |
Nematodos gastroentéricos, pulmonares y céstodos |
| Febantel | Oral |
5 – 10 |
Nematodos gastroentéricos, pulmonares |
| Fenbendazole | Oral |
5 – 7.5 |
Nematodos gastroentéricos, pulmonares y cestodos |
| Mebendazole | Oral |
12.5 |
Nematodos gastroentéricos, pulmonares y cestodos |
| Oxfendazole | Oral/Intra-ruminal |
4.5 – 5 |
Nematodos gastroentéricos, pulmonares y cestodos |
| Oxibendazole | Oral |
10 – 15 |
Nematodos gastroentéricos |
| Parbendazole | Oral |
20 – 30 |
Nematodos gastroentéricos |
| Thiabendazole | Oral |
44 – 110 |
Nematodos gastroentéricos |
| Thiofanato | Oral |
50 – 80 |
Nematodos gastroentéricos, pulmonares |
| Imidazotiazoles | |||
| Tetramisole | Oral |
15 |
Nematodos gastroentéricos y pulmonares |
| Hidroclorido de Levamisole | Oral/Spot-On y sub-cutánea |
7.5 |
Nematodos gastroentéricos y pulmonares |
| Fosfato de Levamisol | Ora y sub-cutánea |
8 - 9 |
Nematodos gastroentéricos y pulmonares |
| Tetrahidopirimidinas | |||
| Morantel | Oral |
10 |
Nematodos gastroentéricos |
| Tartrato de Pirantel | Oral |
25 |
Nematodos gastroentéricos |
| Lactonas macrociclicas | |||
| Ivermectina Doramectina | Oral/Spot-On y sub-cutánea |
200 mcg / Kg |
Nematodos gastroentéricos y pulmonares |
| Moxidectina | sub-cutánea |
200 mcg / Kg |
Nematodos gastroentéricos y pulmonares |
**Bovinos a pastoreo: Adicionar 1,8 Kg de Sulfobendazol en 25 Kg. de sal común o con minerales. Colocar en comederos separados para que los animales puedan consumir dosis medias diarias de 50 g per capita, por un periodo de 2-3 días. Esta cantidad de Sulfoxido de Albendazol provee 7 mg de principio activo por Kg. de peso vivo por día.
Bovinos estabulados: Adicionar 10 mg de Sulfoxido de Albendazol por kg de peso vivo, en la cantidad de ración a ser consumida en un día (dosis única) por los bovinos.
La administración a través de bloques multinutricionales a bovinos a pastoreo ha sido recientemente utilizada con muy buenos resultados.
10. TÉCNICA DE DIAGNÓSTICO ANTE MORTEM.
En vista de que la mayoría de los helmintos liberan sus huevos a nivel intestinal, el diagnóstico de las infestaciones parasitarias puede ser confirmado por la puesta en evidencia de dichas formas de diseminación, mediante el examen de una pequeña cantidad de heces, lo cual constituye la coprología microscópica, cuyas técnicas son en general muy sencillas pero requieren de rigurosidad para evitar la emisión de resultados falsos. Es recomendable tomar la materia fecal directamente del recto del animal, para lo cual son de gran utilidad los guantes plásticos para palpaciones rectales o una simple bolsa plástica invertida colocada a manera de guante en la mano. Las muestras deben ser adecuadamente identificadas y colocadas en cavas de anime con recipientes refrigerantes congelados, para su traslado al laboratorio en donde deben ser procesadas a la brevedad posible (< 48 horas). En caso de no ser factible su procesamiento inmediato deben mantenerse bajo refrigeración (4ºC). El análisis coproscópico cuantitativo, a pesar de sus limitaciones, continúa siendo la herramienta fundamental en el diagnóstico de la helmintosis gastrointestinal de los rumiantes domésticos, debido a su practicidad y bajo costo. Existen variadas técnicas coproscópicas cuantitativas, pero las de uso mas frecuentes tanto a nivel de laboratorios de investigación como de servicio son las siguientes.
10.1. Técnica cuantitativa de McMaster.
Esta técnica requiere de una cámara especialmente diseñada para el conteo de los huevos, conocida como cámara de McMaster y de un liquido de flotación, como la solución sobresaturada de NaCl (400 gramos de sal de cocina + 1000 ml de agua), o la solución de Sheater azúcar (350 gramos de azúcar + 340 ml de agua) cuyas densidades oscilan entre 1,18 a 1,20. Para estimar el número de huevos por gramo de heces, simplemente cada huevo observado dentro ó sobre las líneas de demarcación se multiplica por 50. (Morales y Pino, 1977, 2004; Hansen y Perry, 1994).

10.2. Técnica de Wiscosin.
Esta técnica es de gran utilidad en infestaciones leves, lo cual es frecuente en bovinos adultos y tiene la ventaja de que como se lee al microscopio entre lámina y laminilla, los huevos de los parásitos se pueden observar con mayor nitidez. Es una técnica de sedimentación – flotación. En la primera etapa se mezclan 5 gramos de heces en 30 ml de agua, se tamiza la mezcla y se distribuye el contenido en 2 tubos de ensayo de capacidad para 15 ml y se centrífuga a 800 rpm durante 10 minutos, luego se descarta el sobrenadante y se le añade la solución azucarada hasta 2/3 de la capacidad de los tubos, se mezcla bien y se completa con dicha solución garantizando la formación de un menisco convexo superior, se le coloca una laminilla de 22x22 mm sobre los tubos de centrífuga, se repite la centrifugación a 800 rpm por 10 minutos, se toman estas laminillas y se colocan sobre laminas portaobjetos para su observación al microscopio a 10x. El total de huevos observados se divide entre 5 y así obtenemos la cantidad de huevos por gramo de heces.
Esta técnica es de gran utilidad en infestaciones leves, lo cual es frecuente en bovinos adultos y tiene la ventaja de que como se lee al microscopio entre lámina y laminilla, los huevos de los parásitos se pueden observar con mayor nitidez. Es una técnica de sedimentación – flotación. En la primera etapa se mezclan 5 gramos de heces en 30 ml de agua, se tamiza la mezcla y se distribuye el contenido en 2 tubos de ensayo de capacidad para 15 ml y se centrífuga a 800 rpm durante 10 minutos, luego se descarta el sobrenadante y se le añade la solución azucarada hasta 2/3 de la capacidad de los tubos, se mezcla bien y se completa con dicha solución garantizando la formación de un menisco convexo superior, se le coloca una laminilla de 22x22 mm sobre los tubos de centrífuga, se repite la centrifugación a 800 rpm por 10 minutos, se toman estas laminillas y se colocan sobre laminas portaobjetos para su observación al microscopio a 10x. El total de huevos observados se divide entre 5 y así obtenemos la cantidad de huevos por gramo de heces.
10.3. Técnica de Wiscosin modificada.
Se pesan 3 gramos de material fecal y se le agregan 17 ml de solución azúcar sobresaturada, se trituran las heces, se mezclan bien y se tamiza la mezcla en un colador de té, luego se coloca la mezcla tamizada en un tubo de centrífuga y se centrífuga a 800 rpm por 10 minutos, se le agrega solución azúcar saturada hasta formar meniscos convexos superior y se coloca la laminilla de 22 x 22 mm por 4 minutos, luego se coloca en un portaobjeto y se lee al microscopio con un aumento de 10x, se revisa toda la laminilla y se expresa el resultado en huevos por gramo de heces, luego de dividir el total contado entre 3.
10.3.1. Interpretación del recuento de huevos de estróngilos digestivos por gramo de heces en rumiantes.
La interpretación del significado de los resultados de la coproscopía cuantitativa depende enormemente de la condición del animal examinado, el cual a su vez depende del plano nutricional, debido a que aquellos animales en buenas condiciones y adecuadamente alimentados pueden tolerar altas cargas parasitarias. La presencia de estos animales al interior de un rebaño, es decir que a pesar de estar infectados están saludables, ha llevado a establecer diferencias conceptuales de gran importancia, así vemos, como en la actualidad se manejan los términos de resistencia y resiliencia:
Resistente: término referido a aquellos animales que no se infectan con estróngilos digestivos o que si lo hacen limitan la carga parasitaria.
Resiliente: son aquellos animales que pueden soportar altas cargas parasitarias sin que su rendimiento productivo y estado general de salud se vea negativamente afectado.
Habiendo realizado las aclaratorias anteriores es conveniente establecer su relación con situaciones frecuentemente observadas con animales parasitados en condiciones naturales, en los cuales la relación entre la carga parasitaria y la presencia o ausencia de signos clínicos es dependiente de una serie de factores, entre los cuales destacan el estado nutricional del animal así como la edad. Animales en buen estado nutricional son más resistentes a los efectos de una elevada carga parasitaria que aquellos en deficientes condiciones nutricionales, por otra parte, los animales jóvenes son mas susceptibles que los adultos, de ahí que la interpretación de los resultados de la coproscopía con fines diagnósticos requiere de su análisis conjunto con la historia clínica del animal.
Sin embargo, el análisis coproparasitológico cuantitativo de un lote de animales es un magnifico descriptor de la distribución y abundancia de las cargas parasitarias al interior del rebaño, así como del nivel de contaminación del pastizal. Considerando, que los distintos géneros de nematodos son distintos en cuanto a prolificidad y que en condiciones naturales es normal que se presenten infecciones mixtas, ya que en la naturaleza el poli- parasitismo es la regla. Vamos a presentar algunas tablas para la interpretación de los resultados de la coproscopía cuantitativa en infecciones mixtas, pero previamente realizaremos la definición de los niveles de infestación presentados en las tablas:
Leve: un nivel de infestación que probablemente tiene poco ó ningún efecto sobre la salud o la productividad.
Moderado: un nivel de infestación que afecta tanto la salud como la productividad y requiere de tratamiento.
Elevado: nivel de infestación que afecta seriamente la salud del animal y puede ocasionar la muerte del mismo , requiere de tratamiento inmediato.
Fatal: nivel de infestación responsable de ocasionar la muerte de los animales afectados en caprinos el parasitismo gastrointestinal continúa siendo un problema aún al estado adulto, pudiendo ocasionar mortalidad si no se toman medidas de control a tiempo, esto es debido a que las cabras no desarrollan inmunorresistencia frente a la infección por nematodos, a diferencia de lo que se observa en ovinos y bovinos, que si manifiestan esta resistencia sobre todo los animales adultos. (McKenna, 1985)
Especie |
Leve |
Moderada |
Alta |
Autor |
| Bovino | 50 – 200 |
250 - 800 |
850 |
Hansen y Perry (1994) |
| Bovino | 50 |
100 - 350 |
400 |
Goncalves (1967) |
| Bovino | 15 – 50 |
50 - 500 |
550 |
Euzeby (1981) |
| Ovino | 50 – 800 |
850 - 1200 |
1250 |
Hansen y Perry (1994) |
| Ovino | 350 |
400 - 950 |
1000 |
Goncalves (1967) |
| Caprino | 500 |
600 - 2000 |
2050 |
McKenna (1985) |
10.3.2. Utilidad de la coproscopía cuantitativa en helmintología de rumiantes.
El análisis coproscópico cuantitativo en el campo de la helmintología veterinaria es de gran utilidad, ya que puede ser utilizado para la detección de quimiorresistencia, eficacia de un determinado producto , éxito de la frecuencia y de los intervalos entre tratamientos, evaluación del riesgo potencial de la contaminación del pastizal, desarrollo de programas de tratamientos selectivos y de selección de reproductores helminto-resistentes así como del descarte de aquellos animales que consistentemente se comporten como helminto- sensibles, es decir que después de tratados con un antihelmíntico eficaz sus niveles de reinfestación sean altos.
10.3.3. Examen parasitológico del calostro o de la leche.
Este examen debe realizarse el mismo día del parto y se pueden prolongar durante 5 a 8 días pos parto. Los muestreos deben realizarse preferiblemente 2 veces al día (mañana y tarde) en las siguientes cantidades:
Bovinos: 300 a 500 ml
Ovinos y caprinos: 20 a 50 ml
10.3.4. Procedimiento.
Centrifugación de 20 ml de secreción láctea (previamente homogeneizada) en tubos cónicos, durante 3 minutos a 2000 r.p.m.
Eliminación del sobrenadante, conservándose el sedimento contenido en la parte cónica del tubo.
Agregar una solución de tampón fosfatado de pH 7,2.
Centrifugar a 2000 r.p.m durante 3 minutos
Repetir el proceso por 3 veces consecutivas
Luego de la ultima centrifugación y eliminación del sobrenadante, examinar el sedimento a 40 x para buscar las larvas y realizar su estudio morfológico .
En el caso de las vacas es posible encontrar L2 de de Toxocara vitolorum y L3 o L4 de Strongyloides papillosus, mientras que en los ovinos y caprinos solo es factible encontrar larvas de S. papillosus
Los criterios morfométricos y morfológicos de mayor importancia para la identificación son los siguientes:
a) Strongyloides papillosus (L3 ó L4): 700 a 900 μ de largo y cola trífida.
b) Toxocara vitolorum (L2): 410 a 490 μ de largo, cola afilada y simple.
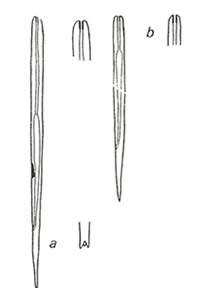
10.4. Técnica de Baermann.
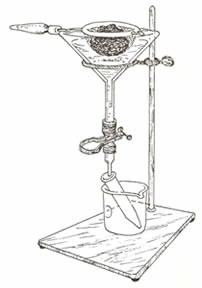
Este es un método muy antiguo (1917), pero de gran vigencia en la actualidad, no habiendo sido superado hasta el presente por ningún otro, dada su simplicidad, exactitud y economía. Es utilizado para el diagnóstico de larvas de Estróngilos pulmonares: Dictyocaulus, Muellerius, Protostrongylus y también para la recuperación de larvas de los Coprocultivos o de muestras de vegetación.
10.4.1. Fundamento de esta técnica.
Debido a que es utilizado para el diagnóstico de formas larvarias, explotamos sus propiedades: movilidad, higrotropismo y termotropismo, así como también la incapacidad que tienen las larvas de Nemátodos de nadar contra la gravedad.
10.4.2. Material necesario.
- Embudo.
-
Tubo de goma.
-
Pinza de Mohr.
-
Gasa.
-
Tamiz. (600 a 700 micrones)
-
Soporte metálico para montar el aparato.
10.4.3. Procedimiento.
El tamaño del aparato a montar, así como la cantidad de heces que vamos a utilizar dependen de la finalidad con la cual hagamos la técnica. Será de tamaño grande y utilizando todas las heces sometidas a cultivo, en caso de recuperación de larvas infestantes con fines experimentales. Pero si el objetivo es el diagnóstico; solo serán necesarios de 5 a 15 grs. de heces y un aparato de pequeña talla.
En todo caso la muestra se envolverá en una capa de gasa, la cual a su vez, será dispuesta en un tamiz metálico o un colador corriente, con mallas de 600 a 700 micrones. Dicho tamiz será colocado en un embudo a cuya extremidad aguda se le conecta un tubo de goma, sellado en su extremo libre por una pinza de Mohr.
Llenar el aparato con agua tibia de manera de que ésta entre en contacto con la masa de las material fecales, pero no quede sobrenadante. Así lo dejaremos por espacio de 24 a 48 horas. Aunque si la muestra es muy rica obtendremos larvas en una hora solamente.
El calor estimula la motilidad de las larvas, las cuales van a salir del seno de las heces por su propiedad higrotrópica y las hallaremos concentradas en el extremo inferior del tubo de goma, de aquí las recogeremos en tubo de ensayos, el cual podemos someter a centrifugación, en caso de que sean escasas las larvas y dispongamos del aparato. (Centrífuga)
Tomar por último una gota del fondo del tubo y colocar entre lámina y laminilla para su observación al microscopio con aumento de 10X.
11. Bibliografía.
Bliss, D ; Kvasnicka ,W(1997). The fecal examination: a missing link in food animal practice beef production management. Parasitology, the compendium,.
Egwang, T. y Slocombe, J(1982) J. Evaluation of the Cornell-Wisconsing centrifugal flotation technique for recovering Trichostrongylid eggs from bovine feces. Can. J. Comp. Med. 46: 133-137. 347 pp.
Euzeby , J (1981). Diagnostic experimental des helmintoses animales.Tome 1Informations Techniques des Services Vétérinaires , Ministére de l ´Agriculture , Paris, 349 pp.
F.A.O (2003). Resistencia a los antiparasitarios. Estado actual con énfasis en América Latina .Estudio FAO de Producción y Sanidad Animal 157, Roma ;51 pp.
Goncalves,P.C (1967). Normas para testes a campo con novos anti-helminticos.Brasil. Mimeografiado , 5pp
Graber ,M; Perrotin,C(1983). Helminthes et helminthoses des ruminants domestiques d´Afrique tropicale. Editions du Point Vétérinaire , Maisons Alfort , Francia , 378 pp.
Hansen, J.y Perry, G. (1994). Helminth parasites of ruminants. The epidemiology diagnosis and control of Helminth parasites of ruminants, F:A.O., Nairobi, Kenya, 171 pp.
McKenna, P. (1985). Diagnosis of gastrointestinal nematode parasitism in goats. Foundation for continuing education of the New Zealand Veterinary Association. Proceding of a course in goats husbandry and medicine. Publication N° 106 ; New Zealand , pp. 86- 95
Morales, G. y Pino, L. A. (1977). Manual de diagnóstico helmintológico en rumiantes. Edit. Colegio de Médicos Veterinarios del estado Aragua, Maracay ,Venezuela, 99 pp.
Skerman, K. y Hillard, J. (1966). A handbook for studies of helminth parasites of ruminants. F.A.O., Teherán, 183 pp.
Urquhart ,G.M ; Armour , J ; Duncan , J.L ; Dunn ,A. M , Jennings , F. W.(1999).Veterinary Parasitology. Blackwell Science , U.K , 307 pp.
 página de |
| Colaboraciones |
| Canales |
| Agricultura |
| Ganadería |
| Alimentación |